Descrizione
DESCRIZIONE MORFOBOTANICA
DESCRIZIONE:
Specie appartenente ai Piromiceti, cioè a funghi ascomiceti che sono in grado di produrre periteci contenenti aschi unitunicati, ossia aschi provvisti di una sola parete chiamata tunica, la quale è costituita da due strati che non si separano durante la fuoriuscita delle spore. I Pirenomiceti sono funghi microscopici con il peritecio contenuto nella carne dei funghi, e costituito da un corpo fruttifero cavo, provvisto di un’apertura apicale.
ASCOMA:
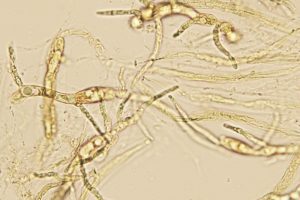
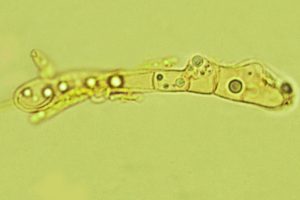
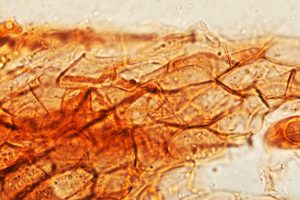
da ampolliforme ad ovoidale, provvisto di papilla, avente un diametro di 360-640 µm ed un’altezza di 360-740 µm. Fruttificazioni a crescita sparsa o gregaria; rivenibili in gruppi di numerosi individui direttamente adesi o leggermente immersi, nel substrato di crescita. Possiedono un tomento cotonoso, ossia una corta e fine peluria, quasi vellutata che li avviluppa. Occasionalmente sulla base vengono riscontrati peli. Il loro colore è biancastro pallido, giallastro pallido, occasionalmente rosa pallido. A volte, con il trascorrere del tempo, i carpofori possono assumere colorazioni arancio-marrone, con residui di peli di colore giallastro. Il collo si presenta conico, di colore nero, glabro. La parete dell’ascoma è costituita da una textura angularis, avente cellule da isiodiametriche ad angolose, con pareti mutualmente compresse e fuse insieme. [MAZZA R. 2012 – pag. 361]. In visione frontale si evidenziano delle formazioni globulari, con presenza di cristalli rifrangenti. La sezione longitudinale è costituita di tre strati, aventi uno spessore di 48,5-71,5 µm. Lo strato interno (pseudoparenchima), ha uno spessore di 7,5-9 µm, ed è costituito da 3-5 strati allungati ed appiattiti, ialini, di cellule brune. Il medio strato, pseudoparenchima, ha uno spessore di 20,5-22 µm, ed è composto di 4-7 strati da poligonali ad angolari di cellule brune. Lo strato esterno prosenchima (tessuto plectenchimatico formato da ife parallele, con o senza anastomosi, o relativamente intrecciate), [MAZZA R. 2012 -pag. 303] ha uno spessore di 20,5-40,5 µm, ed è composto da strati ifali, aventi una larghezza di 1,5-3 µm, con cellule a pareti sottili di colore ialino o marrone chiaro, settate.
L’apice dell’ascoma è costituito da perifisi, ossia da un insieme di ife settate che delimitano l’apertura dell’ostiolo; [MAZZA R. 2012 – pag. 281] in parte esse sono protruse esternamente a questo; si evidenziano colorazioni centrali con tonalità giallognole dovute alla presenza di pigmenti aranciati che diffondono rapidamente in acqua.
Commenti sui taxa simili [https://www-s.life.illinois.edu/pyrenos/records/show_by_page?page=64]
Lasiosphaeria lanuginosa appartiene ad un gruppo di specie, distinte dalle altre consimili, per il fatto di avere l’ascoma rivestito da un feltro ifale fitto, di colore biancastro, giallastro o di rado pallido, con delle ascospore che sviluppano una testa rigonfia ed appendici peduncolate. La Lasiosphaeria lanuginosa può essere quindi distinta dalla Lasiosphaeria ovina in quanto le ascospore della prima, possiedono una testa rigonfia che a volte può assumere tonalità marrone; le parti terminali delle ascospore, hanno inoltre lunghe appendici.
Cercophora sparsa viene separata per le sue corte ascospore e per l’assenza di appendici. Lasiosphaeria lanuginosa può essere distinta dal complesso di specie polifiletico (organismi vicini sul piano sistematico), nel quale la maggior parte di loro possiede una combinazione di caratteri ambigui, che ne rendono difficile il riconoscimento. [MILLER & HUHNDORF, 2004]
L’ontogenesi dell’ascomicete Cercophora palmicola, si ricollega molto bene con lo sviluppo relativo a Sordaria spp (Lasiosphaeriaceae), così come definito da Huang. [http://www.ncbi.nlm.nih.gov/pubmed/10371720]
* La fialide è una cellula conidiogena, sacciforme o con profilo a bottiglia, adibita alla produzione di blastoconidi in successione, senza accrescersi in lunghezza. [MAZZA R. 2012. P. 169]
MICROSCOPIA
SPORE:
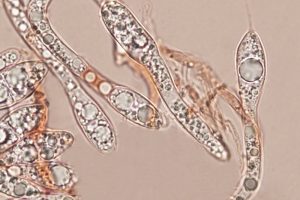
Parafisi più lunghe degli aschi, da filiformi a ventricose, ampie, aventi misura 2-5 µm, ialine, numerose, settate, ramificate, persistenti. Aschi di forma cilindrica aventi misura 120-230 (-300) x 8-20 (-22,5) µm
[https://www-s.life.illinois.edu/pyrenos/records/show_by_page?page=64]
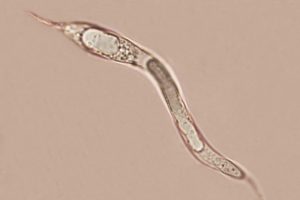
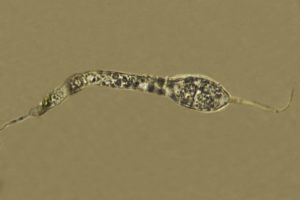
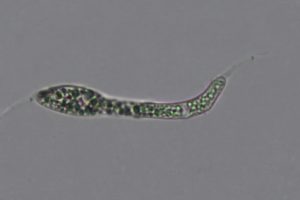
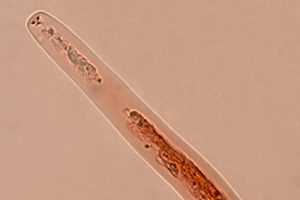
Ascospore biseriate nell’asco, di forma cilindrica, con estremità arrotondata, genicolata, ossia con elementi cellulari nodosi o formati da una successione di brusche inarcature, e dal tratto zigzagante.[MAZZA R. 2012]. Il terzo inferiore dell’ascospora presenta un’angolazione di circa 45°; sono di aspetto gelatinoso, ialine, la loro misura è 33-60 x 2,5-5 µm. Sono prive di setti, con appendici bipolari. Man mano che avanza nel processo di differenziazione, l’ascospora presenta una testa rigonfia ed un peduncolo. All’interno dell’asco le ascospore si presentano unisettate in senso trasversale. La testa dell’ascospora, ha una forma da ellittica ad ovoidale, e misura 11,5-19 x 6-10 µm; essa si presenta subacuta ed arrotondata all’apice, tronca alla base, ialina, a volte con colorazioni marroni. Il peduncolo presenta tonalità cromatiche da ialine a marrone chiaro; esso è di rado monosettato e misura 23,5-32,5 x 3-5 µm. Una volta fuoriuscita, la testa dell’ascospora può assumere un colore marrone chiaro. Le ascospore possono essere mono e bisettate dopo la fuoriuscita dall’asco [MILLER & HUHNDORF, 2004]
valori trovati:
Ascospore: 56,4-57,4 x 4-5,1 μm
Testa ascospore: 14,6-18,8 x 6,6-8,9 μm
Aschi: 188,2- 205 x 9,5-19,3 μm
Opercolo asco: 2,5 x 1,5 μm
Appendici bipolari: 9,7-18 μm
HABITAT:
Rinvenuto su rami decorticati, secchi o decidui, che possiedono ancora resti di corteccia; di rado su foglie morte o erbe di tutto il mondo tra cui: Costarica, Danimarca, Inghilterra, Francia, Perù, Stati Uniti, Venezuela. [MILLER & HUHNDORF, 2004]
LUOGO DI RACCOLTA:
Ritrovato in data 21.08.2014 in località Roccapassa di Amatrice (RI), su un rametto in parte decorticato, marcescente, di latifoglia (Populus nigra).
Long.13.245106
Lat. 42.58283
Alt. 905 m. s.l.m.
UTC 2014-08-21 09 12:59:13+ 0000
Accuracy 5.00
STRUMENTAZIONE USATA:
Osservazione microscopica attuata in luce trasmessa, con il Sistema di Acquisizione delle Immagini (Leica). Foto macro eseguite con macchina fotografica Nikon D 5000; obiettivo Nikon AF-S Micro Nikkor 105 mm.
TECNICHE ANALITICHE USATE:
Osservazione microscopica eseguita su materiale fresco, utilizzando H20; Rosso Congo ammoniacale al 6% per porre in risalto le varie strutture.
BIBLIOGRAFIA:
https://www-s.life.illinois.edu/pyrenos/records/show_by_page?page=64
http://www.ncbi.nlm.nih.gov/pubmed/10371720
Breitenbach J. & Kränzlin 1984 – “Champignons de Suisse”, tome 1- Mykologia, Lucerne. Pag. 266 tav. 335
Cetto B. (1987) – “I Funghi dal vero” vol. 5 pl. N. 1687
Gianfranco Medardi “Atlante Fotografico degli Ascomiceti d’Italia” 2006- Centro Studi Micologici pag. 356
Index Fungorum: http://www.indexfungorum.names/names.asp
Mazza Riccardo – 2012 – Dizionario Illustrato dei Funghi- Mykonolexikon 2- pag.361, pag. 187
Miller, A.N and S.M. Huhndorf. 2004 “Using phylogenetic species recognition to delimit species boundaries and species relationships within Lasiosphaeria”- Mycologia 96(5): 1106-1127
Miller N Hundorf , Sm (2004) “Una classificazione naturale di Lasiosphaeria, basato su sequenze LSU rDNA nucleari”, in mycol. Res. 108(1): 26-34
* La nomenclatura vigente, segue le abbreviazioni dei nomi degli autori dei Taxa Fungini Secondo CABI (Bioscience 2003) Nomi correnti delle specie tratti da “Storia della micologia italiana e primo contributo alla nomenclatura corretta dei funghi” – ISPRA – A.M.B. C.s.m. (Centro Studi Micologici) – manuali e linee guida 104/2013